| Volltext anzeigen | |
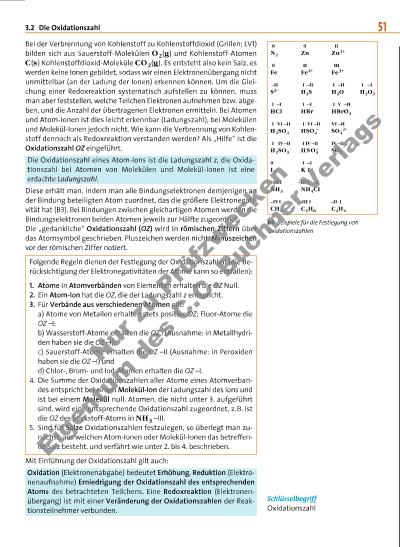
3.2 Die Oxidationszahl 51 Bei der Verbrennung von Kohlenstoff zu Kohlenstoffdioxid (Grillen; LV1) bilden sich aus Sauerstoff-Molekülen O2(g) und Kohlenstoff-Atomen C(s) Kohlenstoffdioxid-Moleküle CO2(g). Es entsteht also kein Salz, es werden keine Ionen gebildet, sodass wir einen Elektronenübergang nicht unmittelbar (an der Ladung der Ionen) erkennen können. Um die Gleichung einer Redoxreaktion systematisch aufstellen zu können, muss man aber feststellen, welche Teilchen Elektronen aufnehmen bzw. abgeben, und die Anzahl der übertragenen Elektronen ermitteln. Bei Atomen und Atom-Ionen ist dies leicht erkennbar (Ladungszahl), bei Molekülen und Molekül-Ionen jedoch nicht. Wie kann die Verbrennung von Kohlenstoff dennoch als Redoxreaktion verstanden werden? Als „Hilfe“ ist die Oxidationszahl OZ eingeführt. Die Oxidationszahl eines Atom-Ions ist die Ladungszahl z, die Oxida tionszahl bei Atomen von Molekülen und Molekül-Ionen ist eine erdachte Ladungszahl. Diese erhält man, indem man alle Bindungselektronen demjenigen an der Bindung beteiligten Atom zuordnet, das die größere Elektronegativität hat (B3). Bei Bindungen zwischen gleichartigen Atomen werden die Bindungselektronen beiden Atomen jeweils zur Hälfte zugeordnet. Die „gedankliche“ Oxidationszahl (OZ) wird in römischen Ziffern über das Atomsymbol geschrieben. Pluszeichen werden nicht, Minuszeichen vor der römischen Ziffer notiert. Folgende Regeln dienen der Festlegung der Oxidationszahlen (die Be rücksichtigung der Elektronegativitäten der Atome kann so entfallen): 1. Atome in Atomverbänden von Elementen erhalten die OZ Null. 2. Ein Atom-Ion hat die OZ, die der Ladungszahl z entspricht. 3. Für Verbände aus verschiedenen Atomen gilt: a) Atome von Metallen erhalten stets positive OZ; Fluor-Atome die OZ –I; b) Wasserstoff-Atome erhalten die OZ I (Ausnahme: in Metallhydriden haben sie die OZ –I); c) Sauerstoff-Atome erhalten die OZ –II (Ausnahme: in Peroxiden haben sie die OZ –I) und d) Chlor-, Bromund Iod-Atomen erhalten die OZ –I. 4. Die Summe der Oxidationszahlen aller Atome eines Atomverbandes entspricht bei einem Molekül-Ion der Ladungszahl des Ions und ist bei einem Molekül null. Atomen, die nicht unter 3. aufgeführt sind, wird eine entsprechende Oxidationszahl zugeordnet, z. B. ist die OZ des Stickstoff-Atoms in NH3 –III. 5. Sind für Salze Oxidationszahlen festzulegen, so überlegt man zu nächst, aus welchen Atom-Ionen oder Molekül-Ionen das betreffende Salz besteht, und verfährt wie unter 2. bis 4. beschrieben. Mit Einführung der Oxidationszahl gilt auch: Oxidation (Elektronenabgabe) bedeutet Erhöhung, Reduktion (Elektronenaufnahme) Erniedrigung der Oxidationszahl des entsprechenden Atoms des betrachteten Teilchens. Eine Redoxreaktion (Elektronen übergang) ist mit einer Veränderung der Oxidationszahlen der Reak tionsteilnehmer verbunden. Schlüsselbegriff Oxidationszahl B4 Beispiele für die Festlegung von Oxidationszahlen 0 0 II N2 Zn Zn 2+ 0 II III Fe Fe2+ Fe3+ –II I –II I –II I –I S2– H2S H2O H2O2 I –I I –I I V –II HCl HBr HBrO3 I VI –II I VI –II VI –II H2SO4 HSO4 – SO4 2– I IV–II I IV –II IV–II H2SO3 HSO3 – SO2 0 I –I I2 K I –III I –III I –I NH3 NH4Cl –IVI –III I –II I CH4 C2H6 C2H4 N u r zu P rü fz w c k e n E ig n tu m d e s C .C . B u c h n e r V e rl a g s | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |