| Volltext anzeigen | |
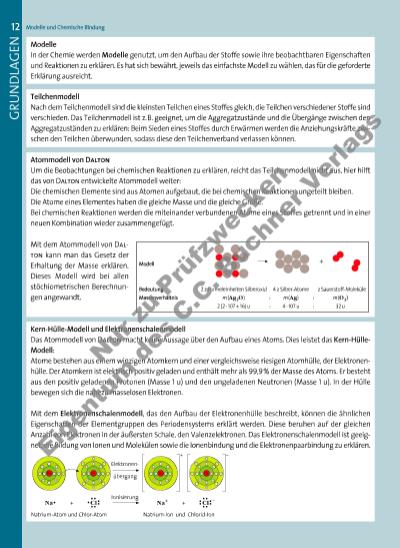
GRUNDLAGEN 13Modelle und Chemische Bindung Elektronenpaar-Abstoßungs-Modell Mit dem Elektronenschalenmodell kann man den räumlichen Bau von Molekülen und die damit verbundenen Stoffeigenschaften nicht erklären. Dazu nutzt man das Elektronenpaar-Abstoßungs-Modell. Danach stoßen sich die bindenden Elektronenpaare, mit denen die Atome in Molekülen aneinander gebunden sind, und die freien Elektronenpaare aufgrund ihrer negativen Ladung gegenseitig ab. Die Elektronenpaare ordnen sich so um das zentrale Atom an, dass sie den größtmöglichen Abstand voneinander haben. Mit dem Elektronenpaar-Abstoßungs-Modell lässt sich z.B. die tetraedrische Struktur des Methan-Moleküls oder die gewinkelte Struktur des Wasser-Moleküls erklären. Zwischenmolekulare Wechselwirkungen Zwischen Molekülen wirken anziehende Kräfte, deren Stärke von der Struktur der Moleküle abhängt. Sie sind maßgeblich für bestimmte charakteristische Eigenschaften der Stoffe wie die Schmelzund Siedetemperatur. Elektronenpaarbindung Ionenbindung Bindung zwischen Atomen in Molekülen Ionen in Ionengittern Charakteristikum gemeinsames Elektronenpaar starke Anziehungskräfte zwischen den entgegengesetzt geladenen Ionen Vorkommen bei Verbindungen aus Nichtmetallen Verbindungen aus Metallen und untereinander Nichtmetallen Name Vorkommen Ursache Stärke Van-der-Waals-Kräfte zwischen allen Teilchen Kurzfristig induzierte Dipole führen an Kontaktstellen zur Anziehung von Nachbarmolekülen. schwach Dipol-Dipol-Kräfte zwischen permanenten Dipol-Molekülen Da der positive und der negative Ladungsschwerpunkt an verschiedenen Stellen des Moleküls liegen, werden die Nachbarmoleküle angezogen. mittelstark Wasserstoffbrücken zwischen Molekülen, in denen H-Atome direkt an F-, Ooder N-Atome gebunden sind. Das partiell positiv geladene H-Atom tritt in Wechselwirkung mit einem nicht bindenden Elektronenpaar eines F-, Ooder N-Atoms des Nachbarmoleküls und stellt so eine „Brücke“ zwischen beiden Molekülen dar. stark (bis zu 25% einer Elektronenpaarbindung) Chemische Bindung 109° R N OH H H R d+d– d– H ClN N Edelgasregel für Ionen Bei Reaktionen geben Metall-Atome in der Regel ihre Valenzelektronen ab, Nichtmetall-Atome nehmen so viele Elektronen auf, dass die Elektronenanzahl des nächsten Edelgas-Atoms erreicht wird. Edelgasregel für Atome in Molekülen Die Anzahl der Elektronen aller bindenden und nicht bindenden Elektronenpaare um den Atomrumpf ist oft so groß wie die Elektronenanzahl des nächsten Edelgas-Atoms. 3377_01_01_2012_001_017 24.09.14 12:09 Seite 13 Nu r z u Pr üf zw ec ke n Ei ge nt um d s C .C . B uc r V er la gs | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |