| Volltext anzeigen | |
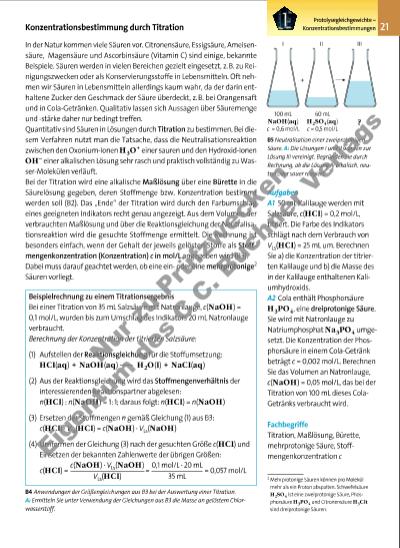
21Protolysegleichgewichte –KonzentrationsbestimmungenKonzentrationsbestimmung durch Titration In der Natur kommen viele Säuren vor. Citronensäure, Essigsäure, Ameisensäure, Magensäure und Ascorbinsäure (Vitamin C) sind einige, bekannte Beispiele. Säuren werden in vielen Bereichen gezielt eingesetzt, z.B. zu Reinigungszwecken oder als Konservierungsstoffe in Lebensmitteln. Oft nehmen wir Säuren in Lebensmitteln allerdings kaum wahr, da der darin enthaltene Zucker den Geschmack der Säure überdeckt, z.B. bei Orangensaft und in Cola-Getränken. Qualitativ lassen sich Aussagen über Säuremenge und -stärke daher nur bedingt treffen. Quantitativ sind Säuren in Lösungen durch Titration zu bestimmen. Bei diesem Verfahren nutzt man die Tatsache, dass die Neutralisationsreaktion zwischen den Oxonium-Ionen H3O+ einer sauren und den Hydroxid-Ionen OH– einer alkalischen Lösung sehr rasch und praktisch vollständig zu Wasser-Molekülen verläuft. Bei der Titration wird eine alkalische Maßlösung über eine Bürette in die Säurelösung gegeben, deren Stoffmenge bzw. Konzentration bestimmt werden soll (B2). Das „Ende“ der Titration wird durch den Farbumschlag eines geeigneten Indikators recht genau angezeigt. Aus dem Volumen der verbrauchten Maßlösung und über die Reaktionsgleichung der Neutralisationsreaktion wird die gesuchte Stoffmenge ermittelt. Die Rechnung ist besonders einfach, wenn der Gehalt der jeweils gelösten Stoffe als Stoffmengenkonzentration (Konzentration) c in mol/L angegeben wird (B3). Dabei muss darauf geachtet werden, ob eine einoder eine mehrprotonige2 Säuren vorliegt. B5 Neutralisation einer zweiprotonigen Säure. A: Die Lösungen I und II werden zur Lösung III vereinigt. Begründen Sie durch Rechnung, ob die Lösung III alkalisch, neutral oder sauer reagiert. Aufgaben A1 50 mL Kalilauge werden mit Salzsäure, c(HCl) = 0,2 mol/L, titriert. Die Farbe des Indikators schlägt nach dem Verbrauch von VLs(HCl) = 25 mL um. Berechnen Sie a) die Konzentration der titrierten Kalilauge und b) die Masse des in der Kalilauge enthaltenen Kaliumhydroxids. A2 Cola enthält Phosphorsäure H3PO4, eine dreiprotonige Säure. Sie wird mit Natronlauge zu Natriumphosphat Na3PO4 umgesetzt. Die Konzentration der Phosphorsäure in einem Cola-Getränk beträgt c = 0,002 mol/L. Berechnen Sie das Volumen an Natronlauge, c(NaOH) = 0,05 mol/L, das bei der Titration von 100 mL dieses ColaGetränks verbraucht wird. + IIIIII B4 Anwendungen der Größengleichungen aus B3 bei der Auswertung einer Titration. A: Ermitteln Sie unter Verwendung der Gleichungen aus B3 die Masse an gelöstem Chlor wasserstoff. c(NaOH) · VLs(NaOH) VLs(HCl) 0,1 mol/L · 20 mL 35 mL 100 mL NaOH(aq) c = 0,6 mol/L 60 mL H2SO4(aq) c = 0,5 mol/L ? Beispielrechnung zu einem Titrationsergebnis Bei einer Titration von 35 mL Salzsäure mit Natronlauge, c(NaOH) = 0,1 mol/L, wurden bis zum Umschlag des Indikators 20 mL Natronlauge verbraucht. Berechnung der Konzentration der titrierten Salzsäure: (1) Aufstellen der Reaktionsgleichung für die Stoffumsetzung: HCl(aq) + NaOH(aq) H2O(l) + NaCl(aq) (2) Aus der Reaktionsgleichung wird das Stoffmengenverhältnis der interessierenden Reaktionspartner abgelesen: n(HCl) : n(NaOH) = 1:1; daraus folgt: n(HCl) = n(NaOH) (3) Ersetzen der Stoffmengen n gemäß Gleichung (1) aus B3: c(HCl) · VLs(HCl) = c(NaOH) · VLs(NaOH) (4) Umformen der Gleichung (3) nach der gesuchten Größe c(HCl) und Einsetzen der bekannten Zahlenwerte der übrigen Größen: c(HCl) = = = 0,057 mol/L Fachbegriffe Titration, Maßlösung, Bürette, mehrprotonige Säure, Stoff mengenkonzentration c 2 Mehrprotonige Säuren können pro Molekül mehr als ein Proton abspalten. Schwefelsäure H2SO4 ist eine zweiprotonige Säure, Phosphorsäure H3PO4 und Citronensäure H3Cit sind dreiprotonige Säuren. 3377_01_01_2012_Kap1_018_057 23.09.14 06:25 Seite 21 Nu r z u Pr üf zw ec ke n Ei ge nt um d es C .C . B uc hn er V er la gs | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |