| Volltext anzeigen | |
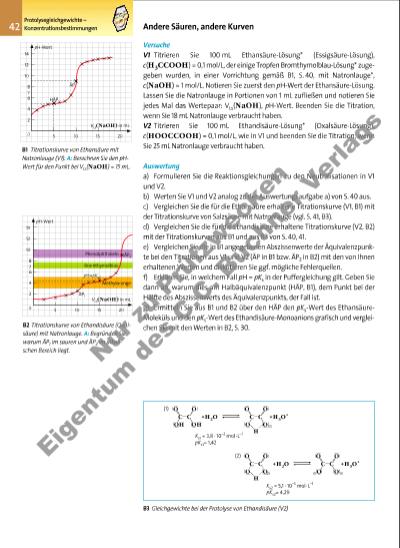
43pKs-Bestimmung durch Halbtitration Protolysegleichgewichte – Konzentrationsbestimmungen 1. Titration einer schwachen Säure mit einer starken Base Wenn 100 mL Ethansäure, c(H3CCOOH) = 0,1 mol/L, mit Natronlauge, c = 1 mol/L, titriert werden (V1), erhält man die Titrationskurve aus B1. Sie unterscheidet sich von der Titrationskurve einer starken Säure mit einer starken Base (vgl. S. 41, B3) in einigen wichtigen Punkten: a) Die Kurve beginnt bei einem höheren pH-Wert, da Ethansäure in Lösung nur in sehr geringem Maße protolysiert vorliegt. b) In dem Intervall vor dem pH-Sprung hat die Titrationskurve in B1 einen stärker ausgeprägten Anstieg. Es liegt ein Acetat-Puffer (vgl. S. 37) vor, dessen Wirkung auf folgenden gekoppelten Gleichgewichten beruht: H3CCOOH(l) + H2O(l) H3O+(aq) + H3CCOO%(aq) (1) H3CCOO %(aq) + H2O(l) H3CCOOH(aq) + OH–(aq) (2) c) Bei der Hälfte des Abszissenwerts des Äquivalenzpunktes hat die Kurve einen ersten Wendepunkt. Bei diesem Halbäquivalenzpunkt HÄP gilt c(H3CCOOH) = c(H3CCOO%). Sein Ordinatenwert gibt den pKs-Wert der Ethansäure an (vgl. Auswertung f) und g) und Puffergleichung, S. 37). Durch Halbtitration kann also der pKs-Wert einer schwachen Säure experimentell bestimmt werden. d) Der Ordinatenwert des Äquivalenzpunktes auf der Titrationskurve von Ethansäure liegt nicht im neutralen Bereich, sondern deutlich verschoben im alkalischen. Da am Äquivalenzpunkt weder Ethansäure noch Natronlauge im Überschuss vorhanden ist, also eine Natriumacetat-Lösung vorliegt, wird der pH-Wert durch die Protolyse der Acetat-Ionen H3CCOO%, einer schwachen Brönsted-Base (vgl. Gleichgewicht (2), bestimmt. Aufgrund dieser Protolyse gilt am Äquivalenzpunkt c(H3O+) < c(OH–) und der pH-Wert der Lösung liegt im alkalischen Bereich. 2. Titration einer zweiprotonigen Säure1 mit einer starken Base Die Titration von Ethandisäure (Oxalsäure) mit Natronlauge liefert eine Titrationskurve mit zwei pH-Sprüngen (V2, B2). Dieser Sachverhalt ist auf die zweistufige Protolyse der Ethandisäure zurückzuführen (B3). Die Oxalsäure-Moleküle reagieren als starke, die Hydrogenoxalat-Ionen als schwache Säure. Für die erste Protolysestufe (1) gemäß B3 tritt auf der Titrationskurve der Äquivalenzpunkt ÄP1 und für die zweite Protolysestufe (2) der Äquivalenzpunkt ÄP2 auf (B2). Deutlich erkennbar verläuft die Titrationskurve bis zum ÄP1 wie die Titrationskurve einer starken Säure und von da ab wie die Titrationskurve einer schwachen Säure (B1). „Auf halber Strecke“ zwischen ÄP1 und ÄP2 liegt der Halbäquivalenzpunkt der zweiten Protolysestufe. Sein Ordinatenwert gibt den pKs-Wert der Anion-Säure Hydrogenoxalat-Ion HOOCCOO% an. B4 Titrationskurven zu A2 Maleinsäure (Z-Butendisäure) pH VLs (NaOH) Farbumschlag 10 8 6 4 2 0 5 10 15 20 Y X H in mL HOOC C COOH C H X H HOOC C COOH C H Y Fumarsäure (E-Butendisäure) Ks1 Ks2 = 20000 Ks1 Ks2 = 23 1 Der hier beschriebene Kurvenverlauf gilt für zweiprotonige Säuren, bei denen die erste Protolysestufe viel leichter erfolgt als die zweite, d.h. bei denen pKs1 erheblich (um mehr als 2 Einheiten) kleiner ist als pKs2. Aufgaben A1 Erklären Sie mithilfe der Formeln in B3 und unter Verwendung geeigneter Fachbegriffe den großen Un terschied zwischen pKs1 und pKs2 bei Ethandisäure (Oxalsäure). A2 Bei der Titration von 20 mL Z-Butendisäure-Lösung (Maleinsäure-Lösung) X und bei der von 20 mL E-Butendisäure-Lösung (Fumarsäure-Lösung) Y mit Natronlauge, c = 0,1 mol/ L, wurden die in B4 angegebenen Titrationskurven erhalten. a) Schlagen Sie einen geeigneten Indikator für diese Titrationen vor. b) Berechnen Sie die Konzentrationen der beiden titrierten Lösungen. c) Erklären Sie die unterschied lichen Kurvenverläufe mithilfe der Angaben zu den beiden Säuren in B4. Fachbegriffe Halbäquivalenzpunkt, Halbtitration 3377_01_01_2012_Kap1_018_057 23.09.14 06:25 Seite 43 Nu r z u Pr üf zw ck en Ei ge nt um d es C .C . B uc hn er V er la gs | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |