| Volltext anzeigen | |
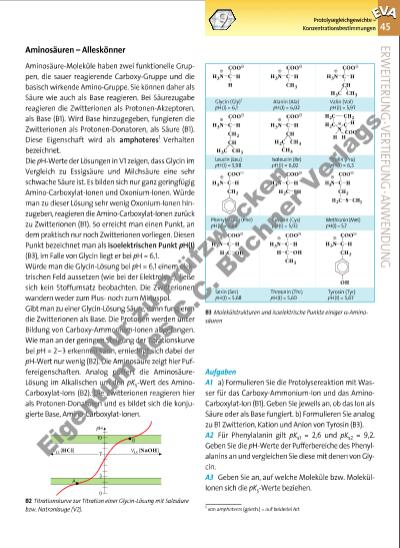
45 Aminosäuren – Alleskönner Aminosäure-Moleküle haben zwei funktionelle Gruppen, die sauer reagierende Carboxy-Gruppe und die basisch wirkende Amino-Gruppe. Sie können daher als Säure wie auch als Base reagieren. Bei Säurezugabe reagieren die Zwitterionen als Protonen-Akzeptoren, als Base (B1). Wird Base hinzugegeben, fungieren die Zwitterionen als Protonen-Donatoren, als Säure (B1). Diese Eigenschaft wird als amphoteres1 Verhalten bezeichnet. Die pH-Werte der Lösungen in V1 zeigen, dass Glycin im Vergleich zu Essigsäure und Milchsäure eine sehr schwache Säure ist. Es bilden sich nur ganz geringfügig Amino-Carboxylat-Ionen und Oxonium-Ionen. Würde man zu dieser Lösung sehr wenig Oxonium-Ionen hinzugeben, reagieren die Amino-Carboxylat-Ionen zurück zu Zwitterionen (B1). So erreicht man einen Punkt, an dem praktisch nur noch Zwitterionen vorliegen. Diesen Punkt bezeichnet man als isoelektrischen Punkt pH(I) (B3), im Falle von Glycin liegt er bei pH = 6,1. Würde man die Glycin-Lösung bei pH = 6,1 einem elektrischen Feld aussetzen (wie bei der Elektrolyse), ließe sich kein Stoffumsatz beobachten. Die Zwitterionen wandern weder zum Plusnoch zum Minuspol. Gibt man zu einer Glycin-Lösung Säure, dann fungieren die Zwitterionen als Base. Die Protonen werden unter Bildung von Carboxy-Ammonium-Ionen abgefangen. Wie man an der geringen Steigung der Titrationskurve bei pH = 2–3 erkennen kann, erniedrigt sich dabei der pH-Wert nur wenig (B2). Die Aminosäure zeigt hier Puffereigenschaften. Analog puffert die AminosäureLösung im Alkalischen um den pKs-Wert des AminoCarboxylat-Ions (B2). Die Zwitterionen reagieren hier als Protonen-Donatoren und es bildet sich die konjugierte Base, Amino-Carboxylat-Ionen. Aufgaben A1 a) Formulieren Sie die Protolysereaktion mit Wasser für das Carboxy-Ammonium-Ion und das AminoCarboxylat-Ion (B1). Geben Sie jeweils an, ob das Ion als Säure oder als Base fungiert. b) Formulieren Sie analog zu B1 Zwitterion, Kation und Anion von Tyrosin (B3). A2 Für Phenylalanin gilt pKs1 = 2,6 und pKs2 = 9,2. Geben Sie die pH-Werte der Pufferbereiche des Phenyl alanins an und vergleichen Sie diese mit denen von Glycin. A3 Geben Sie an, auf welche Moleküle bzw. MolekülIonen sich die pKs-Werte beziehen. ERW EITERUNG·VERTIEFUNG·ANW ENDUNG Protolysegleichgewichte – Konzentrationsbestimmungen B3 Molekülstrukturen und isoelektrische Punkte einiger a-Aminosäuren 1 von amphoteros (griech.) = auf beiderlei Art COO% H3N C H H Glycin (Gly)1 pH (I) = 6,1 Leucin (Leu) pH (I) = 5,98 CH2 COO% H3N C H CH3H3C CH Phenylalanin (Phe) pH (I) = 6,88 CH2 COO% H3N C H H2C COO% H3N C H OH Serin (Ser) pH (I) = 5,68 $ $ $ $ CH3 COO% H3N C H Alanin (Ala) pH (I) = 6,02 CH COO% H3N C H CH3H2C CH3 Isoleucin (Ile) pH (I) = 6,02 H2C COO% H3N C H SH Cystein (Cys) pH (I) = 5,02 COO% H3N C H C OHH CH3 Threonin (Thr) pH (I) = 5,60 $ $ $ $ CH COO% H3N C H CH3H3C Valin (Val) pH (I) = 5,97 Prolin (Pro) pH (I) = 6,3 COO% C H H2C CH2 H2C N H H CH2 COO% H3N C H H2C S CH3 Methionin (Met) pH (I) = 5,7 CH2 COO% H3N C H OH Tyrosin (Tyr) pH (I) = 5,67 $ $ $ $ 3 10 7 pH B A VLs (HCl) VLs (NaOH) 0 B2 Titrationskurve zur Titration einer Glycin-Lösung mit Salzsäure bzw. Natronlauge (V2). 3377_01_01_2012_Kap1_018_057 23.09.14 06:25 Seite 45 Nu r z u Pr üf zw ec ke n Ei ge nt um d es C .C . B uc hn er V er la gs | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |