| Volltext anzeigen | |
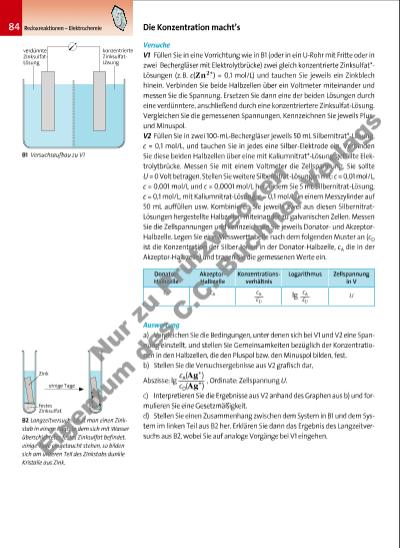
85Redoxreaktionen – Elektrochemie Die bisher betrachteten galvanischen Zellen bestehen aus Halbzellen mit verschiedenen Redoxpaaren. Bei V1 werden nun zunächst zwei identische Zink-Halbzellen miteinander kombiniert, sodass keine Potenzialdifferenz messbar ist. Wenn man aber die Zink-Ionenkonzentration einer Halbzelle ändert, kann man eine Spannung zwischen den beiden Zink-Halbzellen ablesen. Diese Spannung kommt folgendermaßen zustande: Beim Eintauchen eines Zinkblechs in Zinksalz-Lösung gehen einige der Atome als Zink-Ionen in Lösung (vgl. S. 67, B5) und Elektronen bleiben in dem Blech zurück. Es stellt sich das Gleichgewicht Zn(s) Zn2+(aq) + 2 e– ein (vgl. S. 67, B5). Wird die Lösung nun durch Zugabe von Wasser verdünnt, läuft nach dem Prinzip vom kleinsten Zwang verstärkt die Nachbildung der Zink-Ionen ab. Dies führt zu einer Erhöhung des Elektronenüberschusses im Zinkblech und das Potenzial der Halbzelle wird negativer. Die Halbzelle mit der niedrigeren Konzentration fungiert daher als DonatorHalbzelle (als Anode) und die Zink-Elektrode in ihr stellt den Minuspol der Zelle dar. Die Halbzelle mit der höheren Konzentration ist die AkzeptorHalbzelle (die Kathode) und bildet den Pluspol der Zelle (B3). Eine galvanische Zelle aus Halbzellen gleicher Zusammensetzung, aber mit unterschiedlichen Konzentrationen ihrer Lösungen bezeichnet man als Konzentrationszelle. Die Teilreaktionen in der Zink-Konzentrationszelle (B3) können wie folgt zusammengefasst werden: Zn(s) Zn2+(aq) + 2 e– Durch systematische Messung von Potenzialdifferenzen wie in V2 kann die Konzentrationsabhängigkeit der Elektrodenpotenziale verschiedener SilberHalbzellen mit dem Redoxpaar Ag/Ag+ quantitativ erfasst werden. Als Ergebnis aus V2 stellt man fest, dass zwischen zwei Silber-Halbzellen, deren Ionenkonzentrationen c(Ag+) sich um eine Zehnerpotenz unterscheiden, d.h. cA(Ag+)/cD(Ag+) = 10, die Zellspannung U = 0,059 V beträgt. Fasst man die Ergebnisse aus V2 zusammen, so kann die Abhängigkeit der Zellspannung U von den Konzentrationen der Silber-Ionen bei der Silber-Konzentrationszelle durch eine lineare Funktion mit der Steigung 0,059 V und der Variablen lg wiedergegeben werden: U = EA – ED = 0,059 V · lg cA: Konzentration der Akzeptor-, cD: Konzentration der Donator-Halbzelle Bei der Formulierung des Zellendiagramms einer Konzentrationszelle werden immer die Konzentrationen der gelösten Ionen angegeben, z.B. Ag/Ag+, c = 0,01 mol/L//Ag+, c = 0,1 mol/L/Ag. Aufgabe A1 Berechnen Sie die Zellspannung einer Konzentrationszelle aus zwei Silber-Halbzellen mit c(Ag+) = 0,1 mol/L und c(Ag+) = 0,3 mol/L. Konzentrationszellen verdünnte ZinksulfatLösung V konzentrierte ZinksulfatLösung Donator-Halbzelle Zn(s) Zn2+(aq)+2e– Zn2+(aq)+2e– Zn(s) Akzeptor-Halbzelle 2 Cl–(aq) Cl2(g)+2e– Cl2(g)+2e– 2 Cl–(aq) V Donator-HalbzelleAkzeptor-Halbzelle Graphit-Elektroden mit Chlorgas hohe ChloridKonzentration niedrige ChloridKonzentration B4 Bei einer Konzentrationszelle aus zwei Chlor-Halbzellen ist die Halbzelle mit der verdünnten Chlorid-Lösung die AkzeptorHalbzelle. A: Vergleichen Sie diese Konzentrationszelle mit der aus B3 und begründen Sie die Unterschiede. Fachbegriffe Konzentrationszelle, Donatorund Akzeptor-Halbzelle bzw. Anode und Kathode B3 Konzentrationszelle aus zwei Zink-Halbzellen und Reaktionen in den beiden Halbzellen. A: Begründen Sie, warum die Spannung einer solchen Zelle bei Betrieb kontinuierlich abnimmt und geben Sie an, wann sie auf null fällt. verdünnte Lösung konzentrierte Lösung cA(Ag+) cD(Ag+) cA(Ag+) cD(Ag+) 3377_01_01_2012_Kap2_058_123 09.03.15 08:00 Seite 85 Nu r z u Pr üf zw ec ke n Ei ge nt um d es C .C . B uc hn er V rla gs | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |