| Volltext anzeigen | |
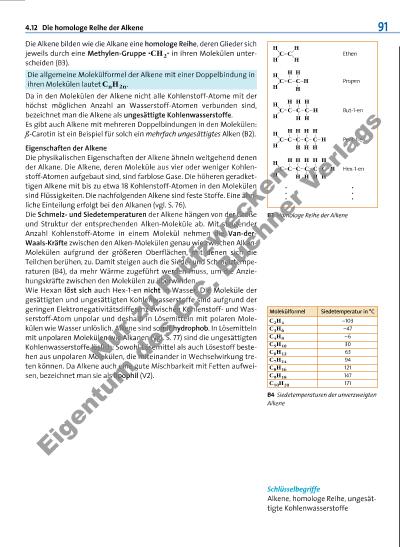
4.12 Die homologe Reihe der Alkene B3 Homologe Reihe der Alkene B4 Siedetemperaturen der unverzweigten Alkene 91 Schlüsselbegriffe Alkene, homologe Reihe, ungesättigte Kohlen wasserstoffe Die Alkene bilden wie die Alkane eine homologe Reihe, deren Glieder sich jeweils durch eine Methylen-Gruppe ·CH2· in ihren Molekülen unterscheiden (B3). Die allgemeine Molekülformel der Alkene mit einer Doppelbindung in ihren Molekülen lautet CnH2n. Da in den Molekülen der Alkene nicht alle Kohlenstoff-Atome mit der höchst möglichen Anzahl an Wasserstoff-Atomen verbunden sind, bezeichnet man die Alkene als ungesättigte Kohlenwasserstoffe. Es gibt auch Alkene mit mehreren Doppelbindungen in den Molekülen: ß-Carotin ist ein Beispiel für solch ein mehrfach ungesättigtes Alken (B2). Eigenschaften der Alkene Die physikalischen Eigenschaften der Alkene ähneln weitgehend denen der Alkane. Die Alkene, deren Moleküle aus vier oder weniger Kohlenstoff-Atomen aufgebaut sind, sind farblose Gase. Die höheren geradkettigen Alkene mit bis zu etwa 18 Kohlenstoff-Atomen in den Molekülen sind Flüssigkeiten. Die nachfolgenden Alkene sind feste Stoffe. Eine ähnliche Einteilung erfolgt bei den Alkanen (vgl. S. 76). Die Schmelzund Siedetemperaturen der Alkene hängen von der Größe und Struktur der entsprechenden Alken-Moleküle ab. Mit steigender Anzahl Kohlenstoff-Atome in einem Molekül nehmen die Van-derWaals-Kräfte zwischen den Alken-Molekülen genau wie zwischen AlkanMolekülen aufgrund der größeren Oberflächen, mit denen sich die Teilchen berühen, zu. Damit steigen auch die Siedeund Schmelztemperaturen (B4), da mehr Wärme zugeführt werden muss, um die Anziehungskräfte zwischen den Molekülen zu überwinden. Wie Hexan löst sich auch Hex-1-en nicht in Wasser. Die Moleküle der gesättigten und ungesättigten Kohlenwasserstoffe sind aufgrund der geringen Elektronegativitätsdifferenz zwischen Kohlenstoffund Wasserstoff-Atom unpolar und deshalb in Lösemitteln mit polaren Mole külen wie Wasser unlöslich. Alkene sind somit hydrophob. In Lösemitteln mit unpolaren Molekülen wie Alkanen (vgl. S. 77) sind die ungesättigten Kohlenwasserstoffe löslich: Sowohl Lösemittel als auch Lösestoff bestehen aus unpolaren Molekülen, die miteinander in Wechselwirkung treten können. Da Alkene auch eine gute Mischbarkeit mit Fetten aufweisen, bezeichnet man sie als lipophil (V2). C H C H H H Ethen C H C H Propen H H C H H . . . Pent-1-enC H C H H H C H H H C H H C H Hex-1-enC H C H H H C H H H C H H C H H C H But-1-enC H H H C H H C H H C H . . . Molekülformel Siedetemperatur in °C C2H4 –103 C3H6 –47 C4H8 –6 C5H10 30 C6H12 63 C7H14 94 C8H16 121 C9H18 147 C10H20 171 N u r zu P rü fz w e c k e n E ig e n tu m d s C .C . B u c h n e r V e rl a g s | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |