| Volltext anzeigen | |
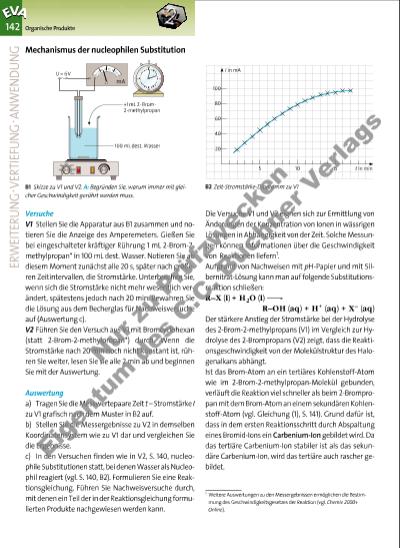
B2 Zeit-Stromstärke-Diagramm zu V1 142 Organische Produkte Versuche V1 Stellen Sie die Apparatur aus B1 zusammen und notieren Sie die Anzeige des Amperemeters. Gießen Sie bei eingeschalteter kräftiger Rührung 1 mL 2-Brom-2methylpropan* in 100 mL dest. Wasser. Notieren Sie ab diesem Moment zunächst alle 20 s, später nach größeren Zeitintervallen, die Stromstärke. Unterbrechen Sie, wenn sich die Stromstärke nicht mehr wesentlich verändert, spätestens jedoch nach 20 min. Bewahren Sie die Lösung aus dem Becherglas für Nachweisversuche auf (Auswertung c). V2 Führen Sie den Versuch aus V1 mit Bromcyclohexan (statt 2-Brom-2-methylpropan*) durch. Wenn die Stromstärke nach 20 min noch nicht konstant ist, rühren Sie weiter, lesen Sie sie alle 2 min ab und beginnen Sie mit der Auswertung. Auswertung a) Tragen Sie die Messwertepaare Zeit t – Stromstärke I zu V1 grafisch nach dem Muster in B2 auf. b) Stellen Sie die Messergebnisse zu V2 in demselben Koordinatensystem wie zu V1 dar und vergleichen Sie die Ergebnisse. c) In den Versuchen finden wie in V2, S. 140, nucleo phile Substitutionen statt, bei denen Wasser als Nucleo phil reagiert (vgl. S. 140, B2). Formulieren Sie eine Reak tionsgleichung. Führen Sie Nachweisversuche durch, mit denen ein Teil der in der Reaktionsgleichung formulierten Produkte nachgewiesen werden kann. Die Versuche V1 und V2 eignen sich zur Ermittlung von Änderungen der Konzentration von Ionen in wässrigen Lösungen in Abhängigkeit von der Zeit. Solche Messungen können Informationen über die Geschwindigkeit von Reaktionen liefern1. Aufgrund von Nachweisen mit pH-Papier und mit Silbernitrat-Lösung kann man auf folgende Substitutionsreaktion schließen: R–X (l) + H2O (l) R–OH (aq) + H+ (aq) + X– (aq) Der stärkere Anstieg der Stromstärke bei der Hydrolyse des 2-Brom-2-methylpropans (V1) im Vergleich zur Hydrolyse des 2-Brompropans (V2) zeigt, dass die Reaktionsgeschwindigkeit von der Molekülstruktur des Halogenalkans abhängt. Ist das Brom-Atom an ein tertiäres Kohlenstoff-Atom wie im 2-Brom-2-methylpropan-Molekül gebunden, verläuft die Reaktion viel schneller als beim 2-Brompropan mit dem Brom-Atom an einem sekundären Kohlenstoff-Atom (vgl. Gleichung (1), S. 141). Grund dafür ist, dass in dem ersten Reaktionsschritt durch Abspaltung eines Bromid-Ions ein Carbenium-Ion gebildet wird. Da das tertiäre Carbenium-Ion stabiler ist als das sekundäre Carbenium-Ion, wird das tertiäre auch rascher gebildet. Mechanismus der nucleophilen Substitution ER W EIT ER UN G· VE RT IEF UN G· AN W EN DU NG B1 Skizze zu V1 und V2. A: Begründen Sie, warum immer mit gleicher Geschwindigkeit gerührt werden muss. 1 Weitere Auswertungen zu den Messergebnissen ermöglichen die Bestimmung des Geschwindigkeitsgesetzes der Reaktion (vgl. Chemie 2000+ Online). +1 mL 2-Brom2-methylpropan U = 6 V mA 100 mL dest. Wasser 60 15 30 45 20 40 60 80 100 5 10 15 t in min I in mA 3377_01_01_2012_Kap3_124_211 23.09.14 06:28 Seite 142 Nu r z u Pr üf zw ec ke n Ei g nt um d es C .C . B uc h er V er la gs | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |