| Volltext anzeigen | |
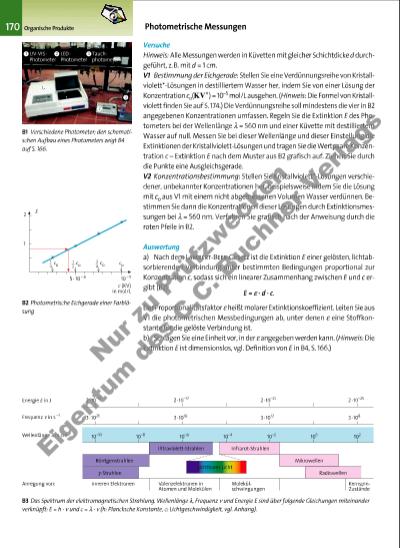
Versuche Hinweis: Alle Messungen werden in Küvetten mit gleicher Schichtdicke d durchgeführt, z.B. mit d = 1 cm. V1 Bestimmung der Eichgerade: Stellen Sie eine Verdünnungsreihe von Kristallviolett*-Lösungen in destilliertem Wasser her, indem Sie von einer Lösung der Konzentration co(KV+) = 10–5 mol/L ausgehen. (Hinweis: Die Formel von Kristallviolett finden Sie auf S. 174.) Die Verdünnungsreihe soll mindestens die vier in B2 angegebenen Konzentrationen umfassen. Regeln Sie die Extinktion E des Photometers bei der Wellenlänge l = 560 nm und einer Küvette mit destilliertem Wasser auf null. Messen Sie bei dieser Wellenlänge und dieser Einstellung die Extinktionen der Kristallviolett-Lösungen und tragen Sie die Wertpaare Konzentration c – Extinktion E nach dem Muster aus B2 grafisch auf. Ziehen Sie durch die Punkte eine Ausgleichsgerade. V2 Konzentrationsbestimmung: Stellen Sie Kristallviolett*-Lösungen verschiedener, unbekannter Konzentrationen her, beispielsweise indem Sie die Lösung mit co aus V1 mit einem nicht abgemessenen Volumen Wasser verdünnen. Bestimmen Sie dann die Konzentrationen dieser Lösungen durch Extinktionsmessungen bei l = 560 nm. Verfahren Sie grafisch nach der Anweisung durch die roten Pfeile in B2. Auswertung a) Nach dem Lambert-Beer-Gesetz ist die Extinktion E einer gelösten, lichtabsorbierenden Verbindung unter bestimmten Bedingungen proportional zur Konzentration c, sodass sich ein linearer Zusammenhang zwischen E und c ergibt (B2): E = e · d · c. Der Proportionalitätsfaktor e heißt molarer Extinktionskoeffizient. Leiten Sie aus V1 die photometrischen Messbedingungen ab, unter denen e eine Stoffkonstante für die gelöste Verbindung ist. b) Schlagen Sie eine Einheit vor, in der e angegeben werden kann. (Hinweis: Die Extinktion E ist dimensionslos, vgl. Definition von E in B4, S. 166.) 170 Organische Produkte Photometrische Messungen B1 Verschiedene Photometer; den schematischen Aufbau eines Photometers zeigt B4 auf S. 166. B2 Photometrische Eichgerade einer Farblösung B3 Das Spektrum der elektromagnetischen Strahlung. Wellenlänge l, Frequenz n und Energie E sind über folgende Gleichungen miteinander verknüpft: E = h · n und c = l · n (h: Plancksche Konstante, c: Lichtgeschwindigkeit, vgl. Anhang). UV-VISPhotometer LEDPhotometer Tauchphotometer 1 1 2 3 1 2 E 1 4 co 12 co 3 4 co co 5 · 10 – 6 10 – 5 c (KV) in mol/L Energie E in J Ultraviolett-Strahlen Frequenz n in s –1 Wellenlänge l in cm 2 · 10–13 2 · 10–17 2 · 10–21 2 · 10–25 3 · 1020 3 · 1016 3 · 1012 3 · 108 10–10 10–8 10–2 10210–6 10–4 100 Röntgenstrahlen g -Strahlen Infrarot-Strahlen Mikrowellen Radiowellen Anregung von: inneren Elektronen Valenzelektronen in Atomen und Molekülen Molekülschwingungen KernspinZustände sichtbares Licht 2 3 3377_01_01_2012_Kap3_124_211 23.09.14 06:28 Seite 170 Nu r z u Pr üf zw ec k n Ei ge nt um d es C .C . B uc hn er Ve rla gs | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |