| Volltext anzeigen | |
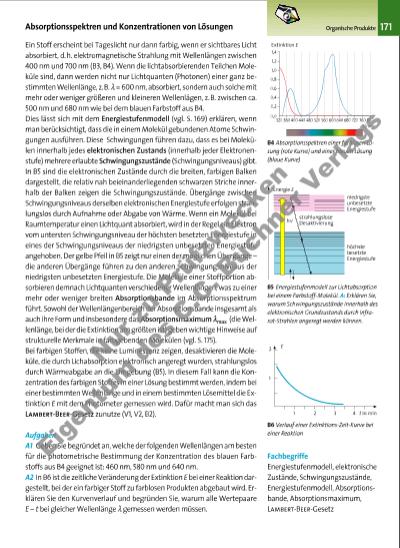
1. UV-Handlampe 2. Lumineszenzprobe 3. Spaltblende 4. Optisches Gitter 5. Blickrichtung 2 134 5 E Singlett-Niveaus l1 Triplett-Niveaus l2 l1 l2< E1 E2> E1 E2 172 Organische Produkte Versuch V1 Echtfarben-Emissionsspektren: Bauen Sie mithilfe einer Spaltblende, eines Gitters und einer optischen Bank aus der Physiksammlung die in B2 dargestellte Vorrichtung auf. Bringen Sie in der angedeuteten Weise verschiedenfarbig leuchtende Fluoreszenzproben zum Leuchten und betrachten Sie die Spektren. Als Fluoreszenzproben eignen sich sehr gut die Lösungen 1, 3 und 4 aus B1. Dabei handelt es sich um wässrige Lösungen von UV-Farbaufheller aus Vollwaschmitteln (1), FluoreszeinNatriumsalz* (3) und Aesculin aus der Rinde eines Kastanienzweigs (4, vgl. V3, S. 168). Vergleichen Sie die von Ihnen gesehenen Spektren mit denen aus B1. Auswertung a) Das Gitter in der Vorrichtung aus B2 übernimmt die Funktion des Prismas aus der Vorrichtung in B1, S. 166. Erläutern Sie, welche Funktion gemeint ist. b) Nennen Sie den Unterschied zwischen den Anordnungen der Lampe in der Vorrichtung aus B2 und im Photometer aus B4, S. 166. Begründen Sie, warum sich die Anordnungen unterscheiden müssen. c) Die Proben 1 und 4 erzeugen eine weiß-bläuliche Fluoreszenz, die Probe 3 eine orange-gelbliche. Nennen und erläutern Sie den Zusammenhang zwischen den Fluoreszenzfarben dieser Proben und den entsprechenden Echtfarben-Emissionsspektren aus B1. d) Prüfen Sie, ob der Zusammenhang, den Sie in c) festgestellt haben, auch für die Probe 2 aus B1 zutrifft. Die spektrale Zerlegung des Fluoreszenzlichts von molekularen Verbindungen liefert Spektren, die in der Regel mehrere Farben enthalten, die wie im Regenbogen ineinander übergehen. Die Spektren sehen aber dennoch anders aus als ein Regenbogen (B1, V1). Der Anteil der einzelnen Farben ist je nach Probe unterschiedlich und oft kommen nicht alle Regenbogenfarben vor. So liefert beispielsweise Fluoreszein eine intensive und breite Emissionsbande im gelben Bereich und zwei schwächere Banden im roten und im grünen Bereich. Mithilfe des Energiestufenmodells und der Aufspaltung der elektronischen Energiestufen in Schwingungsniveaus (vgl. S. 171) lässt sich erklären, warum bei der Fluoreszenz nach der Absorption von Lichtquanten aus dem UV-Bereich Lichtquanten aus dem sichtbaren Bereich emittiert werden (B3). Fluoreszenz und Phosphoreszenz ER W EIT ER UN G· VE RT IEF UN G· AN W EN DU NG B1 Fluoreszierende Proben und ihre Echtfarben-Emissionsspektren (V1) B2 Vorrichtung zur Erzeugung und Sichtbarmachung von Echtfarben-Emissionsspektren (V1) B3 Elektronenübergänge bei der Anregung mit UV-Licht und anschließender Fluoreszenz. A: Erläutern Sie die Energiebilanz bei den dargestellten Übergängen. 1 2 3 3 2 44 1 3377_01_01_2012_Kap3_124_211 23.09.14 06:28 Seite 172 Nu r z u Pr üf zw ec ke n Ei e tu m d es C .C . B uc hn r V er la gs | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |